Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
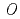 -グルコシル基転移酵素における糖受容体基質の認識機構
-グルコシル基転移酵素における糖受容体基質の認識機構廣本 武史; 本庄 栄二郎*; 玉田 太郎; 黒木 良太; 野田 尚信*; 数馬 恒平*; 鈴木 正彦*
no journal, ,
UDP-グルコース:アントシアニジン3-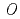 -グルコシル転移酵素(UGT78K6)は、アントシアニン色素の基本骨格をなすアントシアニジン類への糖転移を触媒する酵素で、チョウマメの青色の花弁に含まれるポリアシル化アントシアニン(テルナチン)の生合成の初期段階を担っている。また本酵素は、類似の分子構造を有するにも拘わらず、フラボノール類に対して著しく低い糖転移活性を示すことが知られている。そこで、糖受容体基質の認識に関わる構造基盤を明らかにするため、UGT78K6に各糖受容体基質(アントシアニジンに分類されるデルフィニジンとペチュニジン、またフラボノールの一種であるケンフェロール)が結合した酵素-基質複合体の立体構造を、X線結晶構造解析により、それぞれ2.6
-グルコシル転移酵素(UGT78K6)は、アントシアニン色素の基本骨格をなすアントシアニジン類への糖転移を触媒する酵素で、チョウマメの青色の花弁に含まれるポリアシル化アントシアニン(テルナチン)の生合成の初期段階を担っている。また本酵素は、類似の分子構造を有するにも拘わらず、フラボノール類に対して著しく低い糖転移活性を示すことが知られている。そこで、糖受容体基質の認識に関わる構造基盤を明らかにするため、UGT78K6に各糖受容体基質(アントシアニジンに分類されるデルフィニジンとペチュニジン、またフラボノールの一種であるケンフェロール)が結合した酵素-基質複合体の立体構造を、X線結晶構造解析により、それぞれ2.6 , 2.7
, 2.7 , 1.8
, 1.8 の分解能で決定した。これは、アントシアニジンが酵素に結合した状態を観測した初めての例である。本解析で見出された各糖受容体基質の結合様式は、これまでに報告されている類似の糖転移酵素(赤ブドウ由来
の分解能で決定した。これは、アントシアニジンが酵素に結合した状態を観測した初めての例である。本解析で見出された各糖受容体基質の結合様式は、これまでに報告されている類似の糖転移酵素(赤ブドウ由来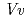 GT1)とは全く異なるものであり、異なる発色を担うアントシアニジンとフラボノールをどのように識別しているのか、その分子メカニズムの解明を可能とした。
GT1)とは全く異なるものであり、異なる発色を担うアントシアニジンとフラボノールをどのように識別しているのか、その分子メカニズムの解明を可能とした。
 -ラクタマーゼの立体構造と低塩濃度における酵素活性維持との相関
-ラクタマーゼの立体構造と低塩濃度における酵素活性維持との相関新井 栄揮; 安達 基泰; 玉田 太郎; 徳永 廣子*; 石橋 松二郎*; 徳永 正雄*; 黒木 良太
no journal, ,
一般的に、豊富な酸性アミノ酸含量を有する好塩性蛋白質は、低塩濃度下では構造が不安定化し、酵素活性などの機能を失う。しかし、中度好塩菌の生息域では、ペリプラズムは0.5M 飽和塩濃度の環境にあり、そこに局在する好塩性蛋白質は低塩濃度への適合も要求される。今回我々は、中度好塩菌ペリプラズム酵素の構造・機能研究の一環として、中度好塩菌
飽和塩濃度の環境にあり、そこに局在する好塩性蛋白質は低塩濃度への適合も要求される。今回我々は、中度好塩菌ペリプラズム酵素の構造・機能研究の一環として、中度好塩菌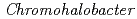 sp.560由来ペリプラズム酵素HaBLAの立体構造をX線結晶回折法によって解析するとともに、その酵素活性を等温滴定熱量測定法により解析した。HaBLAは0
sp.560由来ペリプラズム酵素HaBLAの立体構造をX線結晶回折法によって解析するとともに、その酵素活性を等温滴定熱量測定法により解析した。HaBLAは0 4M NaClにおいてペニシリンGを効果的に分解した。その分解活性は、2M NaCl存在下ではkcat/Km=142.8(S
4M NaClにおいてペニシリンGを効果的に分解した。その分解活性は、2M NaCl存在下ではkcat/Km=142.8(S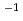
 M
M 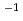 )であり、1
)であり、1 4M NaClの範囲でその50%を維持し、0M NaClでも20%を維持していた。そこで我々は、HaBLA結晶構造を精査し、機能発現に関わる構造的特徴を調べた。その結果、HaBLA表面は大部分が負電荷で占められるが、活性部位周辺に局所的に正電荷を有するとともに、活性部位入口に疎水性クラスターを有することを発見した。ペニシリンGは負電荷を有するともに芳香環も有する。HaBLAは活性部位周辺の正電荷による静電相互作用と疎水性クラスターによる疎水性相互作用によってペニシリンGを活性部位へ誘導し、低塩濃度での活性を維持していると考えられる。
4M NaClの範囲でその50%を維持し、0M NaClでも20%を維持していた。そこで我々は、HaBLA結晶構造を精査し、機能発現に関わる構造的特徴を調べた。その結果、HaBLA表面は大部分が負電荷で占められるが、活性部位周辺に局所的に正電荷を有するとともに、活性部位入口に疎水性クラスターを有することを発見した。ペニシリンGは負電荷を有するともに芳香環も有する。HaBLAは活性部位周辺の正電荷による静電相互作用と疎水性クラスターによる疎水性相互作用によってペニシリンGを活性部位へ誘導し、低塩濃度での活性を維持していると考えられる。
栗原 和男; 友寄 克亮; 玉田 太郎; 黒木 良太
no journal, ,
膜タンパク質やタンパク質複合体などの立体構造解析に基づくタンパク質間相互作用の解明は、現代の生命科学研究における重要な領域であり、中性子結晶構造解析から得られる水素原子や水和水の立体構造情報は、タンパク質の機能解明や高機能化に大きく寄与する。しかし、ここで対象となる高分子量タンパク質は、試料結晶の単位胞体積も大きくなり、既存の中性子回折装置では対応できていない。そこで我々は、J-PARC(大強度陽子加速器施設)に、大型単位胞結晶(目標値:格子長250 )をも測定可能にする中性子回折装置の建設を推進している(J-PARC中性子実験装置部会での2次(最終)審査合格済み)。この測定実現には、空間方向に加え時間方向での反射スポットの分離が鍵となる。そこで、カメラ半径を長くし(800mm)、線源には中性子パルス時間幅が短い減速材(非結合型)を選択する。中性子ガイド管設計では、非結合型減速材表面の高輝度部分(高さ40mm
)をも測定可能にする中性子回折装置の建設を推進している(J-PARC中性子実験装置部会での2次(最終)審査合格済み)。この測定実現には、空間方向に加え時間方向での反射スポットの分離が鍵となる。そこで、カメラ半径を長くし(800mm)、線源には中性子パルス時間幅が短い減速材(非結合型)を選択する。中性子ガイド管設計では、非結合型減速材表面の高輝度部分(高さ40mm 幅60mm。波長2.86
幅60mm。波長2.86 以上において減速材表面全体の平均輝度に比べ1.24倍の輝度)のみを利用するように設計を行った。また、垂直方向は、スーパーミラー反射回数の増加による強度の低減を図るため楕円形状した。水平方向では、不要な
以上において減速材表面全体の平均輝度に比べ1.24倍の輝度)のみを利用するように設計を行った。また、垂直方向は、スーパーミラー反射回数の増加による強度の低減を図るため楕円形状した。水平方向では、不要な 線や波長の短い中性子を除去するため、曲管形状を取り入れた。McStasコードによる軌跡シミュレーションから、試料位置での強度は5
線や波長の短い中性子を除去するため、曲管形状を取り入れた。McStasコードによる軌跡シミュレーションから、試料位置での強度は5 10
10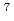 /cm
/cm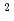 /s(波長1.5
/s(波長1.5 -5.6
-5.6 (第1フレーム))と見積られている。
(第1フレーム))と見積られている。
友寄 克亮; 栗原 和男; 玉田 太郎; 黒木 良太
no journal, ,
構造生物学研究において、膜タンパク質やタンパク質複合体などの大型タンパク質は重要な研究対象の一つである。これらの大型タンパク質の水素原子や水和水を含む立体構造解析から、機能メカニズムを解明することは、生命科学に大きな進展をもたらす。我々は、J-PARC(大強度陽子加速器施設)に大型単位格子をもつタンパク質結晶の中性子回折実験を可能とする新装置の建設を提案している。散乱実験での飛行時間測定法において一番の長所は飛行距離を大きくとることによりエネルギー(あるいは時間)分解能を改善することが可能であることである。J-PARCに建設予定の新装置でも飛行距離を大きくとることにより長格子タンパク質の測定も可能になるが、ビームラインの設置の物理的な制約もありパルス幅が比較的短い非結合型減速材(DM)を新装置の線源として優先的に検討している。しかしJ-PARC/MLFには、他にさらに強度が強い結合型減速材(CM)やよりパルス幅が短い非結合型ポイゾン減速材(PM)の2種類の減速材も存在する。J-PARC/MLFの3種類の線源データを用いて、簡易的な装置モデルを用いて長格子(~250 )測定実現のための装置パラメータの評価を行った。低角バンクの検出器では面間隔の決定精度が悪化するため角度分散を改善できるようコリメータやスリット等での調整が必要となる。散乱角に依存した反射分離評価を行い、最適なL1(第一飛行距離), L2(カメラ長)および発散角を検討したのでポスターにて報告する。
)測定実現のための装置パラメータの評価を行った。低角バンクの検出器では面間隔の決定精度が悪化するため角度分散を改善できるようコリメータやスリット等での調整が必要となる。散乱角に依存した反射分離評価を行い、最適なL1(第一飛行距離), L2(カメラ長)および発散角を検討したのでポスターにて報告する。
玉田 太郎
no journal, ,
電子伝達タンパク質の多くは、ヘム, フラビン, 鉄硫黄クラスターなどの補欠分子族を結合し、補欠分子族を介した水素原子や外殻電子の移動により電子伝達が行われる。よって、電子伝達機構を理解するためには、水素原子を含めた構造情報を高精度に得ることが必要となる。そこで、分子構造ダイナミクス研究グループでは、高電位鉄硫黄タンパク質(HiPIP)とNADHシトクロムb5還元酵素(b5R)の2つの電子伝達タンパク質を対象として、高分解能中性子結晶構造解析を試みた。中性子回折実験は大強度陽子加速器施設(J-PARC)のBL03ビームライン(iBIX)において100K下で実施し、HiPIPについてはタンパク質の中性子回折データとしては世界最高分解能に並ぶ1.1 分解能、b5Rについても高い分解能(1.4
分解能、b5Rについても高い分解能(1.4 分解能)の回折データ収集に成功した。現在、同一結晶から取得したX線回折データを相補的に用いた構造精密化を実施中であるが、超高分解能のX線結晶構造においても観測が困難であったタンパク質表面の解離性残基のプロトン化状態や水分子の配向に加え、理想値からずれた水素原子の結合距離、結合角も多数観測している。本発表では、高分解能中性子構造の詳細を報告するとともに、我々が新たにJ-PARCに設置を検討しているタンパク質解析専用のビームラインについても紹介する。本ビームラインは構造生物学研究者の共同利用を目的としており、従来の回折計では対応できなかった250
分解能)の回折データ収集に成功した。現在、同一結晶から取得したX線回折データを相補的に用いた構造精密化を実施中であるが、超高分解能のX線結晶構造においても観測が困難であったタンパク質表面の解離性残基のプロトン化状態や水分子の配向に加え、理想値からずれた水素原子の結合距離、結合角も多数観測している。本発表では、高分解能中性子構造の詳細を報告するとともに、我々が新たにJ-PARCに設置を検討しているタンパク質解析専用のビームラインについても紹介する。本ビームラインは構造生物学研究者の共同利用を目的としており、従来の回折計では対応できなかった250 を超える大型格子結晶からの中性子回折データ収集を念頭に設計を進めている。
を超える大型格子結晶からの中性子回折データ収集を念頭に設計を進めている。
平山 裕士; 安達 基泰; 清水 瑠美; 黒木 良太
no journal, ,
ノイラミニダーゼは、インフルエンザウイルスが宿主細胞から遊離する際に、宿主の糖タンパク質のシアル酸を切断する酵素である。ノイラミニダーゼは、分子内に8個のSS結合を持ち、真核生物分泌発現系での発現が望ましい。そこで我々は、鳥インフルエンザノイラミニダーゼをメタノール資化酵母(GS115)で発現させることを試みた。まず酵母発現系に最適化した鳥インフルエンザノイラミニダーゼの遺伝子を化学合成し、同時に精製を容易にするためのN末端にヒスチジンタグの付加、および化学的安定性の向上を目的として分子表面にあるシステイン(C161)をセリンへ置換(His-C161Sノイラミニダーゼ)した。His-C161Sノイラミニダーゼは酵母で大量(培地1Lあたり約60mg)に発現したが、N型糖鎖付加配列に変異導入した糖鎖欠損変異体(N88R/N146R/N235R)は、培養上清には発現しなかった。このことは、ノイラミニダーゼの発現に糖鎖付加が不可欠であることを示唆する。培養上清を回収後、4Mグアニジン塩酸塩により変性させ、Niカラムにより精製した。得られた試料を透析によって再生後陰イオン交換樹脂で精製した。精製試料は、基質fetuinに対して約200U/mgの活性を示し、機能を保持していることを確認した。メタノール資化酵母による発現は、試料の完全重水素化にも有利であり、中性子構造解析を目的とした鳥インフルエンザノイラミニダーゼの完全重水素化が次の課題である。
米谷 佳晃
no journal, ,
DNAに結合する蛋白質は、細胞中の膨大なDNA塩基配列の中からどのようにターゲット配列を見つけ出すのだろうか?1分子蛍光測定やNMR測定の結果から、蛋白質は1次元サーチと3次元サーチを利用してDNA配列を探索していると考えられてきた。1次元サーチでは、蛋白質はDNAとのコンタクトを保ったままDNAに沿って移動する(スライド)。一方、3次元サーチでは、DNAから離れて溶液中を移動する(ホッピング,ジャンピング)。現在、この2つの過程が重要であると考えられているが、各過程の頻度など詳細は分かっていない。そのため、分子動力学シミュレーションによりDNA周囲の蛋白質の移動に対する自由エネルギー地形を計算し、DNA配列探索中の蛋白質の動態を解明しようと試みた。蛋白質ラックリプレッサーを対象に計算した結果、特異的結合状態、非特異的結合状態 のいずれの場合でも、蛋白質がDNAから解離する際の自由エネルギー障壁は、16kcal/mol以上あることが分かった。一方、DNAに沿ったスライド方向の移動については、Furiniらが同じ蛋白質に対して計算しており、自由エネルギー障壁は~8.7kcal/molであることが示されている。両者を比べると、解離方向の自由エネルギー障壁の方が、スライド方向よりも著しく大きいことが分かる。したがって、蛋白質がいったんDNAに結合すると、DNAから離れることはまれで、主にDNAに沿って移動していると考えられる。
清水 瑠美; 廣本 武史; 安達 基泰; 柴崎 千枝; 黒木 良太
no journal, ,
T4ファージリゾチーム(T4L)は、大腸菌の細胞壁を構成するムラミルペプチドを加水分解し、溶菌を引き起こす酵素である。野生型T4Lは、加水分解後の生成物のアノマー構造を逆転する酵素であるが、26番目のThr残基を部位特異的にHis残基に置換したT26H変異型酵素は、加水分解生成物のアノマー構造を保持する酵素に変換されるのみならず、高い糖転移活性を獲得する。一般に糖加水分解酵素では、酸性残基の2つのカルボン酸がそれぞれ酸塩基触媒として機能するが、T26H変異型酵素ではカルボン酸の代わりにヒスチジン側鎖が反応に関与する。そこで、変異型酵素に導入したHis残基の糖転移反応における役割と隣接する酸性残基(Asp20)との関係を中性子構造解析により明らかにするため、T26H変異型T4Lの完全重水素化とその大型結晶作製を試みた。タンパク質試料は、一般的な大腸菌発現ベクター(pET-24a)を用い、完全重水素化培地で組換え大腸菌を培養後、過剰発現させることによって調製した。取得した試料を用いて、タンパク質濃度と沈殿剤濃度を変化させたスクリーニングを実施し、約0.9mm の結晶を取得した。米国オークリッジ国立研究所の研究用原子炉(HFIR)に設置されたイメージングプレート単結晶回折計(IMAGINE)を用いた室温での中性子回折実験の結果、2.1
の結晶を取得した。米国オークリッジ国立研究所の研究用原子炉(HFIR)に設置されたイメージングプレート単結晶回折計(IMAGINE)を用いた室温での中性子回折実験の結果、2.1 分解能の回折強度データを完全性79.8%で収集することに成功した。
分解能の回折強度データを完全性79.8%で収集することに成功した。
平野 優; 玉田 太郎; 栗原 和男; 日下 勝弘*; 三木 邦夫*
no journal, ,
タンパク質の構造や機能を理解するために水素原子の情報は重要である。これまでタンパク質中の水素原子の構造は、低分子から得られた結合距離、結合角の理想値に基づいて議論されてきた。したがって理想値の制約を受けない水素原子の構造情報を取得することは、タンパク質研究に大きく貢献すると考えられる。中性子は水素原子についても比較的大きい散乱能をもつため、中性子構造解析において水素原子の検出は容易である。本研究では、HiPIPを用い高分解能での中性子構造解析を行った。中性子回折実験は、大強度陽子加速器施設J-PARC物質・生命科学実験施設(MLF)のBL03(iBIX)ビームラインにおいて行い、タンパク質としては世界最高分解能である1.1 分解能の回折データを得ることができた。構造精密化の結果、超高分解能のX線構造においても観測の困難であった、タンパク質表面の解離性アミノ酸残基のプロトン化状態を決定することができた。また、水素原子の結合距離、結合角において理想値からのずれを多数観測することができた。
分解能の回折データを得ることができた。構造精密化の結果、超高分解能のX線構造においても観測の困難であった、タンパク質表面の解離性アミノ酸残基のプロトン化状態を決定することができた。また、水素原子の結合距離、結合角において理想値からのずれを多数観測することができた。
角南 智子; 河野 秀俊
no journal, ,
転写因子がゲノム中のある特定の塩基配列を正確に認識することは、遺伝子の発現制御のために重要な役割を果たしている。任意のDNA配列を特異的に認識する蛋白質を人工的に作製することができれば、遺伝情報の発現制御や修復など様々な分野への応用が考えられる。近年、このような人工転写因子として、TALEや亜鉛フィンガー蛋白質をベースとして、いくつかの開発例が報告されている。しかし、現存の人工転写因子は依然として、低配列特異性による毒性などの問題があり、特異性を上げることが望まれている。そのためには、DNAと転写因子の相互作用を解析し、特異性を出している仕組みを理解する必要がある。我々は、この目的のために、エングレイルドホメオドメイン蛋白質(EN)に注目し、新たな配列特異性を持つ転写因子の開発を目指して研究を進めている。ENは6塩基長の塩基配列を特異的に認識する小型の球状蛋白質である。原核生物でも真核生物でもよく発現し、変異体の調製が容易である利点がある。我々は、配列特性を上げるためにより長い領域結合するように、2つのENをタンデムにつないだ蛋白質を作成した。そして、この蛋白質は高い結合活性と高い配列特異性を有していることを明らかにした。我々は、結合活性及び配列特異性を最適化するため、現在、この2つのドメイン間をつなぐリンカーの長さに注目して、B1H法(Meng et al., 2006)などを利用してスクリーニングを行っているので、進捗を報告する。
中川 洋
no journal, ,
生体分子ダイナミクスは広い時空間で特徴付けられる。中性子非弾性散乱は、溶媒とカップルしたテラヘルツ領域のダイナミクスやドメイン運動を観測する強力な手法である。またこの方法は、水和水ダイナミクスの計測にも適している。分子シミュレーションは実験データを解釈する有効な手法である。蛋白質の動力学転移と水和水ダイナミクスとの関係性、溶媒とカップルした蛋白質の拡散運動、ドメイン運動に関する研究成果を発表する。
上村 拓也*; 喜田 昭子*; 安達 基泰; 黒木 良太; 森本 幸生*
no journal, ,
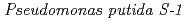 由来のサリチル酸水酸化酵素(SALH)は、分子量45kDa、分子内にFADを1つ持つフラビン酵素である。この酵素はNADHと分子状酵素の存在下でサリチル酸の脱炭酸・水酸化を同時に行いカテコールを生成する一原子酵素添加反応を触媒する。類似酵素であるパラ(PHBH)あるいはメタヒドロキシ安息香酸水酸化酵素(MHBH)は脱炭酸反応を触媒しない。これらの立体構造から、2種の反応機構の解析や活性部位周辺のアミノ酸残基の解析などが行われているが、その反応過程には不明点が多い。したがって、本酵素の反応機構を明らかにするために、基質であるサリチル酸との複合体の構造解析を行った。上記株由来の遺伝子情報からHisタグ融合酵素を大腸菌で発現させ、単離・精製・結晶化を行い、SPring-8において放射光回折実験を行い分解能2.5
由来のサリチル酸水酸化酵素(SALH)は、分子量45kDa、分子内にFADを1つ持つフラビン酵素である。この酵素はNADHと分子状酵素の存在下でサリチル酸の脱炭酸・水酸化を同時に行いカテコールを生成する一原子酵素添加反応を触媒する。類似酵素であるパラ(PHBH)あるいはメタヒドロキシ安息香酸水酸化酵素(MHBH)は脱炭酸反応を触媒しない。これらの立体構造から、2種の反応機構の解析や活性部位周辺のアミノ酸残基の解析などが行われているが、その反応過程には不明点が多い。したがって、本酵素の反応機構を明らかにするために、基質であるサリチル酸との複合体の構造解析を行った。上記株由来の遺伝子情報からHisタグ融合酵素を大腸菌で発現させ、単離・精製・結晶化を行い、SPring-8において放射光回折実験を行い分解能2.5 で構造を決定した。PHBHやMHBHでは基質であるパラあるいはメタ安息香酸のカルボキシル基を周辺のアミノ酸が保持しているが、本酵素ではこの部位はむしろFAD側に向き、保持するアミノ酸残基は存在しない。この配置から基質の脱炭酸と水酸基付与についての機構を考察した。
で構造を決定した。PHBHやMHBHでは基質であるパラあるいはメタ安息香酸のカルボキシル基を周辺のアミノ酸が保持しているが、本酵素ではこの部位はむしろFAD側に向き、保持するアミノ酸残基は存在しない。この配置から基質の脱炭酸と水酸基付与についての機構を考察した。